Las investigaciones clínicas de dispositivos médicos son estudios sistemáticos que implican a uno o más sujetos humanos, con el objetivo de evaluar la seguridad, el rendimiento clínico y la efectividad de un dispositivo médico. Este proceso es fundamental para demostrar que un dispositivo es seguro y funciona como se espera en condiciones normales de uso. A través de estas investigaciones, se busca establecer y verificar la seguridad clínica, el rendimiento y los beneficios clínicos, así como identificar efectos secundarios conocidos y desconocidos.
Las investigaciones clínicas están reguladas por estándares internacionales como la ISO 14155:2020, que establece buenas prácticas para el diseño, la realización, el registro y la presentación de informes de las investigaciones clínicas. En la Unión Europea, estas investigaciones son un componente clave del proceso de evaluación de conformidad bajo el Reglamento de Dispositivos Médicos (MDR), especialmente para dispositivos de alto riesgo, donde generalmente se requiere una investigación clínica. En este artículo, se explorarán las normas y procesos esenciales que rigen las investigaciones clínicas de dispositivos médicos, así como su importancia en el ámbito de la salud.
Puntos clave:
- Las investigaciones clínicas son esenciales para evaluar la seguridad y efectividad de los dispositivos médicos.
- Están reguladas por estándares internacionales como la ISO 14155:2020 y el MDR en Europa.
- El proceso incluye varias fases: planificación, preparación y ejecución, con un enfoque en la protección de los sujetos humanos.
- Las investigaciones clínicas difieren de las evaluaciones clínicas, que se basan en datos existentes sin involucrar sujetos humanos.
- En EE. UU., las investigaciones están reguladas por el programa de Exención de Dispositivos Investigacionales (IDE) administrado por la FDA.
Comprendiendo las investigaciones clínicas de dispositivos médicos y su importancia
Las investigaciones clínicas de dispositivos médicos son estudios sistemáticos que buscan evaluar la seguridad y la efectividad de un dispositivo. Estas investigaciones son fundamentales para garantizar que los dispositivos médicos funcionen correctamente en condiciones normales de uso. Al realizar estas investigaciones, se pueden identificar tanto los beneficios clínicos como los efectos secundarios, lo que es clave para la salud pública.
El propósito principal de estas investigaciones es establecer la seguridad clínica y el rendimiento de los dispositivos médicos. Al hacerlo, se protege a los pacientes y se asegura que los dispositivos cumplan con los estándares necesarios antes de ser utilizados en la práctica clínica. Sin estas investigaciones, sería difícil confirmar que un dispositivo es seguro y eficaz, lo que podría poner en riesgo la salud de los pacientes.
Proceso de investigación clínica y su impacto en la seguridad
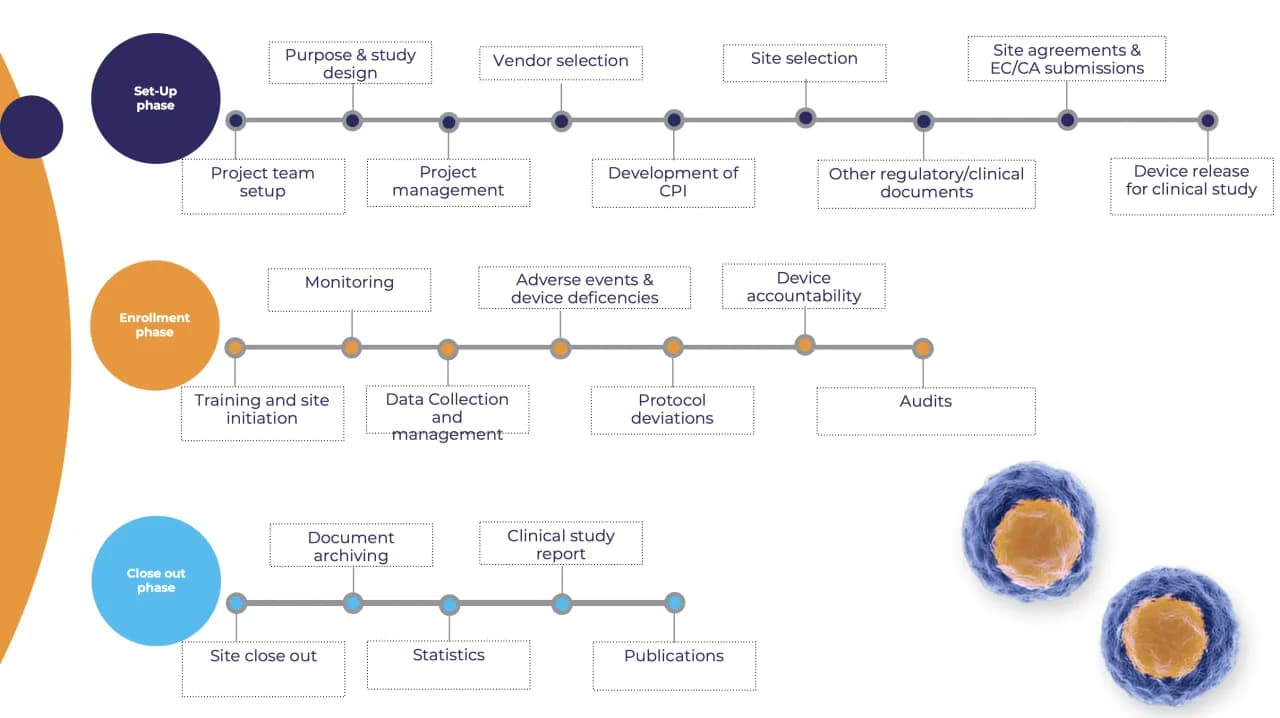
El proceso de investigación clínica consta de varias etapas, comenzando con la planificación. Durante esta fase, se diseñan los estudios y se establecen los objetivos que se desean alcanzar. Posteriormente, se lleva a cabo la ejecución del estudio, donde se recopilan datos de los participantes, asegurando siempre su protección y bienestar.
Una vez finalizada la recopilación de datos, se procede al análisis de los resultados. Este análisis es crucial, ya que permite determinar si el dispositivo cumple con los estándares de seguridad y efectividad. Así, el proceso de investigación clínica no solo ayuda a validar un dispositivo, sino que también tiene un impacto significativo en la seguridad del paciente, garantizando que solo los dispositivos seguros y efectivos lleguen al mercado.
Evaluación de la efectividad de dispositivos médicos en estudios clínicos
La evaluación de la efectividad de los dispositivos médicos es un aspecto crucial en los estudios clínicos sobre dispositivos médicos. Esta evaluación se realiza a través de métodos sistemáticos que permiten medir si un dispositivo cumple con los objetivos establecidos. Se utilizan diferentes métricas, como la tasa de éxito del tratamiento, la reducción de síntomas y la mejora en la calidad de vida de los pacientes. Estos métodos son esenciales para garantizar que los dispositivos proporcionen los beneficios clínicos esperados.
Además, la efectividad se evalúa mediante el análisis de datos obtenidos durante las fases de prueba. Esto incluye la recopilación de información sobre los resultados de salud de los participantes y la comparación de estos resultados con los de un grupo de control. La importancia de esta evaluación radica en que permite a los investigadores y reguladores tomar decisiones informadas sobre la aprobación y el uso de los dispositivos en la práctica clínica. Sin una evaluación rigurosa, sería difícil justificar la introducción de nuevos dispositivos al mercado.
Normativas y estándares que regulan las investigaciones clínicas
Las normativas y estándares internacionales son fundamentales para guiar las investigaciones clínicas de dispositivos médicos. Estas regulaciones aseguran que se sigan prácticas adecuadas en el diseño, la realización y el informe de los estudios. Una de las normativas más importantes es la ISO 14155:2020, que establece buenas prácticas para la protección de los sujetos humanos y la integridad científica del estudio. La aplicación de estas normas es esencial para mantener la credibilidad y la calidad de los resultados obtenidos.
En la práctica, estas normativas no solo ayudan a los investigadores a cumplir con los requisitos éticos y científicos, sino que también proporcionan un marco para la evaluación de la seguridad y efectividad de los dispositivos. En la Unión Europea, el Reglamento de Dispositivos Médicos (MDR) también juega un papel crucial en la regulación de las investigaciones clínicas. Este reglamento establece requisitos específicos para los dispositivos médicos, asegurando que se realicen investigaciones adecuadas antes de su comercialización. Así, las normativas son clave para proteger la salud pública y garantizar que los dispositivos médicos sean seguros y eficaces.
ISO 14155:2020 y su aplicación en la investigación clínica
La norma ISO 14155:2020 establece un marco de buenas prácticas para la realización de investigaciones clínicas de dispositivos médicos. Esta norma es crucial para asegurar la protección de los sujetos humanos y la integridad científica de los estudios. Incluye directrices sobre el diseño, la ejecución, el registro y la presentación de informes de las investigaciones clínicas. Al seguir estas pautas, se garantiza la credibilidad de los resultados y se fomenta la confianza en los datos obtenidos. En la práctica, la aplicación de la norma ISO 14155:2020 implica que todos los participantes en la investigación, incluidos los patrocinadores y los investigadores, deben cumplir con los estándares establecidos. Esto asegura que se respeten los derechos y el bienestar de los sujetos humanos durante todo el proceso de investigación. Además, la norma ayuda a los investigadores a documentar sus hallazgos de manera efectiva, lo que es fundamental para la evaluación posterior de los dispositivos médicos.Regulaciones del MDR en la Unión Europea y su relevancia
El Reglamento de Dispositivos Médicos (MDR) de la Unión Europea es una regulación clave que impacta directamente en las investigaciones clínicas de dispositivos médicos. Este reglamento establece requisitos específicos para la evaluación de la seguridad y el rendimiento de los dispositivos antes de su comercialización. La importancia del MDR radica en su capacidad para garantizar que solo los dispositivos que demuestran ser seguros y efectivos lleguen al mercado, protegiendo así la salud pública.
Además, el MDR exige que los fabricantes realicen investigaciones clínicas adecuadas para respaldar sus afirmaciones sobre el rendimiento de los dispositivos. Esto implica un proceso riguroso que incluye la planificación, la ejecución y el análisis de los estudios clínicos. La regulación no solo mejora la calidad de los datos obtenidos, sino que también fomenta la transparencia en el proceso de evaluación, lo que es fundamental para la confianza de los profesionales de la salud y los pacientes en los dispositivos médicos.
Leer más: Composición y roles del médico en un equipo de investigación eficaz
Diferencias entre investigaciones clínicas y evaluaciones clínicas
Las investigaciones clínicas y las evaluaciones clínicas son dos procesos fundamentales en el ámbito de los dispositivos médicos, pero tienen objetivos y enfoques muy distintos. Las investigaciones clínicas se centran en generar nuevos datos sobre la seguridad y efectividad de un dispositivo mediante estudios sistemáticos que involucran a sujetos humanos. Por otro lado, las evaluaciones clínicas se basan en el análisis de datos existentes, buscando validar la información sobre un dispositivo ya aprobado. Esta diferencia en los objetivos es crucial para entender cómo se utilizan ambos procesos en la práctica clínica.
Además, los métodos empleados en cada enfoque son significativamente diferentes. Mientras que las investigaciones clínicas requieren la planificación y ejecución de ensayos controlados, las evaluaciones clínicas se fundamentan en la recopilación y análisis de datos clínicos previos. Esta distinción resalta la importancia de las investigaciones clínicas para obtener información nueva y específica, mientras que las evaluaciones clínicas son esenciales para mantener la vigilancia sobre la seguridad y el rendimiento de los dispositivos a lo largo de su ciclo de vida. Así, ambos procesos son complementarios, pero cumplen funciones únicas en la regulación de los dispositivos médicos.
Cómo se diferencian los objetivos y métodos de cada enfoque
Los objetivos de las investigaciones clínicas son claros: se busca obtener evidencia nueva sobre la seguridad y la efectividad de un dispositivo médico. Esto implica diseñar estudios que puedan responder preguntas específicas sobre el rendimiento del dispositivo en condiciones controladas. En contraste, las evaluaciones clínicas se centran en revisar y analizar datos ya existentes para confirmar la seguridad y eficacia de un dispositivo que ya está en el mercado.
En cuanto a los métodos, las investigaciones clínicas suelen utilizar ensayos aleatorios controlados, donde los sujetos son asignados a grupos de tratamiento y control para evaluar los efectos del dispositivo. Por su parte, las evaluaciones clínicas emplean análisis de datos recopilados de estudios anteriores, revisiones sistemáticas y meta-análisis para validar la información sobre el dispositivo. Esta diferencia en métodos resalta la necesidad de ambos enfoques para garantizar que los dispositivos médicos sean seguros y efectivos a lo largo del tiempo.
Dispositivos de alto riesgo y su implicación en estudios clínicos
Los dispositivos médicos de alto riesgo son aquellos que, debido a su función o a la naturaleza de su uso, pueden tener un impacto significativo en la salud de los pacientes. Estos dispositivos requieren una evaluación rigurosa a través de estudios clínicos para asegurar su seguridad y efectividad. La evaluación de estos dispositivos implica un proceso exhaustivo que incluye la recolección de datos de rendimiento y la identificación de posibles efectos adversos. Debido a su naturaleza crítica, los ensayos clínicos de dispositivos de alto riesgo son esenciales para garantizar que solo aquellos que cumplen con los estándares necesarios sean aprobados para su uso en la práctica clínica.
La evaluación de dispositivos de alto riesgo se lleva a cabo a través de ensayos clínicos controlados que siguen protocolos estrictos. Estos ensayos permiten a los investigadores observar cómo se comporta el dispositivo en un entorno real y recopilar datos necesarios para su análisis. Es fundamental que los resultados sean transparentes y accesibles para su revisión por parte de las autoridades reguladoras, lo que ayuda a establecer la confianza en el uso de estos dispositivos. Así, la evaluación de dispositivos de alto riesgo no solo protege a los pacientes, sino que también contribuye a la integridad del sistema de salud en general.
| Dispositivo | Especificaciones | Resultados de estudios clínicos |
| Marcapasos XYZ | Implantable, duración de batería de 10 años | 95% de efectividad en la regulación del ritmo cardíaco |
| Prótesis de cadera ABC | Material de titanio, diseño modular | Menos del 2% de complicaciones postoperatorias |
| Stent coronario DEF | Recubierto con fármaco, diámetro de 3 mm | Reducción del 80% en la reestenosis |
Ejemplos de dispositivos médicos de clase III y su evaluación
Los dispositivos médicos de clase III son considerados de alto riesgo y, por lo tanto, requieren una evaluación clínica exhaustiva antes de su comercialización. Estos dispositivos incluyen marcapasos, prótesis de cadera y stents coronarios, que son fundamentales para el tratamiento de diversas condiciones médicas. Cada uno de estos dispositivos debe pasar por ensayos clínicos que demuestren su seguridad y efectividad en una población adecuada de pacientes antes de recibir la aprobación regulatoria.
Por ejemplo, el marcapasos XYZ ha demostrado ser altamente efectivo en la regulación del ritmo cardíaco, con un 95% de éxito en estudios clínicos. De manera similar, la prótesis de cadera ABC ha mostrado una tasa de complicaciones postoperatorias inferior al 2%, lo que resalta su seguridad en la aplicación clínica. Estos resultados no solo validan la efectividad de estos dispositivos, sino que también son esenciales para que los profesionales de la salud confíen en su uso en pacientes.
Innovaciones tecnológicas en la evaluación de dispositivos médicos
Con el avance de la tecnología, las investigaciones clínicas de dispositivos médicos están experimentando una transformación significativa. Nuevas técnicas, como el uso de inteligencia artificial y big data, están comenzando a desempeñar un papel crucial en la evaluación de dispositivos de alto riesgo. Estas herramientas permiten analizar grandes volúmenes de datos de manera más eficiente, identificando patrones y resultados que podrían pasar desapercibidos en estudios tradicionales. Por ejemplo, la inteligencia artificial puede predecir complicaciones potenciales en pacientes que utilizan dispositivos como marcapasos, mejorando así la personalización del tratamiento.Además, la implementación de tecnologías de monitorización remota está revolucionando la forma en que se evalúan los dispositivos en tiempo real. Los dispositivos médicos que cuentan con capacidades de conectividad pueden enviar datos directamente a los profesionales de la salud, permitiendo una supervisión continua y una respuesta rápida ante cualquier eventualidad. Esta integración de tecnología no solo optimiza la evaluación de dispositivos médicos, sino que también eleva la calidad de la atención al paciente, asegurando que los dispositivos se mantengan efectivos y seguros a lo largo de su uso.